COMPONENTES DE UNA SOLUCIÓN.- Las sustancias componentes de una solución son:
1.- SOLUTO.- Es el componente menos abundante de una solución.
2.- DISOLVENTE.- Es el componente más abundante en la solución.
Los componentes de una solución se pueden encontrar en cualesquier estado físico.
Cuando el disolvente en una solución es el agua, la solución se llama solución acuosa; si es alcohol, solución alcohólica, etc.
Cuando se disuelve una sustancia molecular en el agua, el soluto se divide hasta obtener moléculas individuales y la solución se llama molecular, que se caracteriza por ser mala conductora de la corriente eléctrica; pero, si se disuelve un compuesto iónico en agua, el soluto se divide hasta obtener iones positivos y negativos y la solución se llama iónica y se caracteriza por ser buena conductora de electricidad.
CONCENTRACIÓN DE UNA SOLUCIÓN.- Si en una solución la cantidad de soluto existente es pequeña, se afirma que la solución es diluida y concentrada, cuando la cantidad de soluto es grande. Cuando a cierta temperatura no es posible disolver más soluto en la solución, se dice que estamos frente a una solución saturada y si, además, tiene un exceso de soluto, se afirma que es una solución sobresaturada.
El término concentración de una solución lo usamos, con frecuencia para referirnos a la descripción de la composición de una solución, es decir, para expresar la cantidad de soluto que existe en una determinada cantidad de solución.
MÉTODOS PARA EXPRESAR LA CONCENTRACIÓN DE UNA SOLUCIÓN.- Para expresar la concentración de una solución podemos usar unidades físicas o unidades químicas.
1.- UNIDADES FÍSICAS.- Entre otras tenemos:
a) PARTES POR MILLÓN (ppm).- Expresa la concentración como el número de miligramos de soluto por litro de disolución.
 Ejemplo.- El agua que contiene 0,05 ppm de Pb+2, es considerada inapta para el consumo humano. Esta solución contiene 0,05 mg de Pb+2 por cada litro de agua.
Ejemplo.- El agua que contiene 0,05 ppm de Pb+2, es considerada inapta para el consumo humano. Esta solución contiene 0,05 mg de Pb+2 por cada litro de agua.b) PORCENTAJE EN PESO.- O soluciones porcentuales son aquellas en las que la composición de una solución se expresa en términos de peso de soluto por cada 100 unidades de peso de solución.
Ejemplo.- Una solución al 15% en peso de cloruro de sodio tiene la siguiente composición: 15 g de cloruro de sodio en 100 g de solución.
CONSTRUYENDO MEMORIA DE LARO PLAZO ( 45)
- ¿Cuántos gramos de solución al 15% de NaCl se necesita para extraer 38g de cloruro de sodio evaporando el agua? Rpta.- 253g
- Cuántos gramos de ácido clorhídrico concentrado que tiene una concentración del 37,9% de HCl en peso se requiere para disponer de 5g de HCl puro. Rpta.- 13,2g
- Se necesita preparar 250g de solución de Na(OH) al 19,7% en peso. ¿Cuántos gramos de Na(OH) y agua se necesitan? Rpta.- 49,25 y 200,75g
- ¿Cuál es la concentración porcentual de la solución que contiene 85g de H2SO4 en 500 g de solución? Rpta.- 16%
- ¿Con qué cantidad de agua deben diluirse 40g de ácido nítrico para obtener una solución al 5% en peso de dicha sustancia? Rpta.- 760g
- Calcular el volumen ocupado por 100g de solución de Na(OH) cuya densidad es de 1,20g/cc. Rpta.- 83,3ml.
- Calcular el peso de ácido clorhídrico puro que existe en 5ml de ácido clorhídrico cuya concentración es de 37,23% de peso y su densidad de 1,19g/cc. Rpta.- 2,22g
- Calcular el volumen de H2SO4 concentrado, del 98% en peso y densidad de 1,84g/cc que contendrá 40g de ácido puro. Rpta.- 22,17cc
- ¿Qué volumen de ácido nítrico, HNO3, diluido de densidad 1,11g/cc y con 19% de HNO3 en peso contiene 10 g de dicha sustancia pura? Rpta.- 47ml.
2.- UNIDADES QUÍMICAS.- Entre ellas tenemos:
a) MOLARIDAD.-(M) La molaridad de una solución está determinada por el número de moles (n) de soluto que existen en cada litro de solución.

Ejemplo.- Una solución de concentración 2 Molar (2M) tiene la siguiente composición: 2 moles de soluto en cada litro de solución.
Todos sabemos que para determinar el número de moles de soluto que existen en una cantidad determinada de gramos de una sustancia se puede usar la siguiente fórmula:
 Si reemplazamos n de la fórmula (1) por esta expresión obtenemos la siguiente fórmula que nos permite realizar cálculos sobre soluciones molares.
Si reemplazamos n de la fórmula (1) por esta expresión obtenemos la siguiente fórmula que nos permite realizar cálculos sobre soluciones molares.
CONSTRUYENDO MEMORIA DEL LARGO PLAZO (46)
- ¿Cuál es la molaridad de la solución que contiene 250g de CaCl2 en 1500ml de solución? Rpta.- 1,5M
- ¿Qué peso de hidróxido de calcio se requiere para preparar 2,5 litros de solución 1,2 molar de dicha sustancia? Rpta.- 222g
- ¿Qué peso de soluto hay en 800 ml de solución 0,5 molar de HNO3? Rpta.- 25,2g
- ¿Cuál es la concentración molar de la solución que contiene 10g de HCl en 50 ml de solución? Rpta.- 5,5M
- ¿Qué volumen de solución 0,75 M podría prepararse con 500 g de Na2SO4? Rpta.- 4,61 l. 6.- Hallar la molaridad de la solución que contiene 196g de H2SO4 en 500 ml de solución. Rpta.- 4 mol/l
- ¿Cuántos gramos de permanganato de potasio, KMnO4, se requieren para preparar 500ml de solución 2 M de dicha sustancia? Rpta.- 158g
- ¿Cuántos gramos de NaCl hay en 250 ml de solución 2,5 molar? Rpta.- 36.56g
- ¿Cuál es la molaridad de la solución que con tiene 100mg de HNO3 en 10 mililitros de solución? Rpta.- 0.12 M.
- ¿Cuál es la concentración molar de la solución que contiene 12 milimoles de HI en 100 ml de solución? Rpta.- 0,12 M
- ¿Cuántos mililitros de HCl, cuya concentración es de 38% y su densidad de 1,19g/ml, se requieren para preparar 2 litros de solución 0,3 molar?
b) NORMALIDAD.-(N) La normalidad de una solución está determinada por el número de equivalentes-gramo de soluto que existen en cada litro de solución.

Ejemplo: Si una solución tiene una concentración 0,7 normal (0,7N) posee la siguiente composición: Contiene 0,7 eq-g de soluto en cada litro de solución.
Todos sabemos que para determinar el número de eq-g de soluto que existen en una cantidad determinada de gramos de una sustancia se puede usar la siguiente fórmula:

Si reemplazamos # Eq-g, en la fórmula (2) por esta expresión, obtenemos la siguiente fórmula que nos permite realizar cálculos sobre soluciones normales.
 Ejemplo: Si una solución tiene una concentración 2,5 molal es que tiene la siguiente composición: Contiene 2,5 moles de soluto en un kilogramo de disolvente.
Ejemplo: Si una solución tiene una concentración 2,5 molal es que tiene la siguiente composición: Contiene 2,5 moles de soluto en un kilogramo de disolvente.CONSTRUYENDO MEMORIA DE LARGO PLAZO ( 47)
- ¿Qué concentración normal tiene la solución que contiene 10,5 g de H2SO4 en 1,5 litros de solución? Rpta.- 0,14 N
- Una solución contiene 50 mg de FeCl3 en 0,5 litros de solución. ¿Cuál es su normalidad? Rpta.- 0,0015 N
- Hallar la concentración normal de la solución que contiene 450g de NaOH en 2 litros de solución. Rpta.- 5,6 N
- ¿Cuántos gramos de Ca(OH)2 se deben añadir al agua para obtener 3 litros de solución 0,1N? Rpta.- 11,1g
- Calcula el número de equivalentes gramo de Na2CO3 que se debe disolver para preparar 250 cc de solución 0,08 N. Rpta.- 0,02 eq-g
- ¿Cuántos cm3 de H2SO4, de 96% de pureza y una densidad de 1,8g/cc, se requieren para preparar 400 cc de solución 0,1N? Rpta.-
- ¿Cuál será la normalidad de la solución de H2SO4 al 98% en peso cuya densidad es de 1,8g/cc? Rpta.-
- Queremos preparar 17,31ml de solución de KMnO4 0,692 N para utiulizarla en una reacción donde MnO4- pasa a Mn2+. ¿Cuántos gramos de KMnO4 se necesitan? Rpta.- 0,379g.
DILUYENDO SOLUCIONES.- Algunas veces, en el laboratorio, se diluyen soluciones de concentración conocida con una cantidad, también conocida, de agua destilada o se mezclan soluciones de concentración conocida, necesitando saber cual es la concentración de la solución resultante. A continuación presentaremos, mediante problemas resueltos, la forma de realizar esos cálculos usando las siguientes fórmulas.
Fórmulas para realizar cálculos sobre disolución de soluciones Fórmula para realizar cálculos sobre mezcla de soluciones de concentración conocida
Fórmula para realizar cálculos sobre mezcla de soluciones de concentración conocida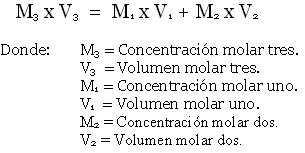


CONSTRUYENDO MEMORIA DE LARGO PLAZO ( 48)
- Calcular el volumen de agua que debe añadirse a 250 ml de una solución 1,25 N para hacerla 0,5 N. Rpta.- 375 ml.
- ¿Qué volúmenes de HCl 12N y 3 N deben mezclarse para dar 1 litro de HCl 6N? Rpta.- 1/3 L 12N, 2/3 L 3N
- ¿Qué volumen de agua se debe agregar a 400 g de alcohol etílico al 80% para bajarlo al 20%? Rpta.- 1200g.
- Se tiene 150ml de una solución 0,3M de ácido sulfúrico, si se le agrega 20ml de agua, ¿cuál será la molaridad de la nueva solución? Rpta.- 0,27mol/L

ESTA PAGINA ABURRIDA NO TIENE NADA DE LO QUE YO NECESITO JAJAJAJ A LOS QUE LA HISISERON NO SON MUY BUENOS ESTA PAGINA ES BUENO INTERNET ES UN FRACASO USTEDES SON BRIYANTE LOS FELICITO
ResponderEliminarALEJANDRA BEITER
92 AÑOS JAJAJJA NO SE RIAN DE ESO PPORFAVOR
m32cristina.....muy bueno, me ayudo para mi examen ..gracias ..muy bien explicado cris
ResponderEliminarThank... =)
ResponderEliminarlos ejercicios denberian estar resueltos paso a paso!!!!!
ResponderEliminarsolo sugerencias
gracias
ho que tal le agradeceré respuesta a los items 6y 7 del punto 47.
ResponderEliminargracias he ta buena la informacion me ayudo un buen
ResponderEliminarkirosvet Claro que debió ser aburrida para ti, porque no creo que estés a este nivel para comprenderla, primero deberías pasar por la escuela a ver si aprendes a escribir
ResponderEliminarayuda como puedo hacer los primero ejercicios
ResponderEliminarCONSTRUYENDO MEMORIA DE LARO PLAZO ( 45) si me puede ayudar
que cosa tan mal explicada! me parecio que el tema no fue totalmente profundizado. :p
ResponderEliminarMe ayufo muchooooo!!! Gracias :D
ResponderEliminar